学科历史

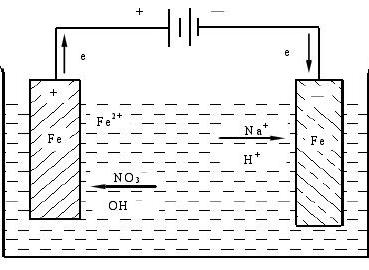
不锈钢管件电化学抛光
1791年L·伽伐尼发表了金属能使蛙腿肌肉抽缩的“动物电”现象,一般认为这是电化学的起源。1799年A·伏打在伽伐尼工作的基础上发明了用不同的金属片夹湿纸组成的“电堆”,即所谓“伏打堆”。这是化学电源的雏型。在直流电机发明以前,各种化学电源是唯一能提供恒稳电流的电源。1834年法拉第电解定律的发现为电化学奠定了定量基础。
19世纪下半叶,经过H.von亥姆霍兹和J.W.吉布斯的工作,赋于电池的“起电力”(今称“电动势”)以明确的热力学含义。1889年W.H.能斯脱用热力学导出了参与电极反应的物质浓度与电极电势的关系,即著名的能斯脱公式。
1923年P.德拜和E.休克尔提出了人们普遍接受的强电解质稀溶液静电理论,大大促进了电化学在理论探讨和实验方法方面的发展。40年代以后电化学暂态技术的应用和发展、电化学方法与光学和表面技术的联用,使人们可以研究快速和复杂的电极反应,可提供电极界面上分子的信息。电化学的发展与固体物理、催化、生命科学等学科互相渗透。电化学一直是物理化学中比较活跃的分支学科。
学科内容
电池由两个电极和电极之间的电解质构成,因而电化学的研究内容应包括两个方面:一是电解质的研究,即电解质学,其中包括电解质的导电性质、离子的传输性质、参与反应离子的平衡性质等,其中电解质溶液的物理化学研究常称作电解质溶液理论;另一方面是电极的研究,即电极学,其中包括电极的平衡性质和通电后的极化性质,也就是电极和电解质界面上的电化学行为。电解质学和电极学的研究都会涉及到化学热力学、化学动力学和物质结构。
研究对象
电化学研究对象应当包括三个部分:电子导体、离子导体、两类导体的界面及其上所发生的一切变化。有关电子导体结构和性质的研究,属于物理学的范围,电化学中只是引进其结论就够了。电解质溶液理论则是对离子导体研究中的主要组成部分,是经典电化学的重要领域。至于两类导体界面性质及界面上所发生的变化,则是近代电化学的主体部分。
研究方法
电化学研究方法包括实验条件的控制、实验结果的测量和实验结果的解析三个主要内容。实验条件的控制是根据实验的要求而控制电解池系统极化的电位、电流(或电量)和极化的程度(小幅度和大幅度),改变极化的方式(恒定、阶跃、方波、扫描、正弦波或载波等)和改变极化的时间(稳态和暂态)。实验结果的测量,一般对象时电极电位、电流、阻抗以及它们随时间的变化。实验结果的解析,用于对测量数据与电极过程参数间的关系解析研究,在电化学研究的原理指导下控制条件并测量在此控制条件下的结果,这是电化学测试的主要任务。
学科应用
电化学保护

sp500电化学打标机
根据电化学腐蚀原理,依靠外部电流的流入改变金属的电位,从而降低金属腐蚀速度的一种材料保护技术。按照金属电位变动的趋向,电化学保护分为阴极保护和阳极保护两类。①阴极保护。通过降低金属电位而达到保护目的的,称为阴极保护。根据保护电流的来源,阴极保护有外加电流法和牺牲阳极法。外加电流法是由外部直流电源提供保护电流,电源的负极连接保护对象,正极连接辅助阳极,通过电解质环境构成电流回路。牺牲阳极法是依靠电位负于保护对象的金属(牺牲阳极)自身消耗来提供保护电流,保护对象直接与牺牲阳极连接,在电解质环境中构成保护电流回路。阴极保护主要用于防止土壤、海水等中性介质中的金属腐蚀。②阳极保护。通过提高可钝化金属的电位使其进入钝态而达到保护目的的,称为阳极保护。阳极保护是利用阳极极化电流使金属处于稳定的钝态,其保护系统类似于外加电流阴极保护系统,只是极化电流的方向相反。只有具有活化-钝化转变的腐蚀体系才能采用阳极保护技术,例如浓硫酸贮罐、氨水贮槽等。
大型工业应用
在物理化学的众多分支中,电化学是唯一以大工业为基础的学科。它的应用分为以下几个方面:①电解工业,其中的氯碱工业是仅次于合成氨和硫酸的无机物基础工业、耐纶66的中间单体己二腈是通过电解合成的;铝、钠等轻金属的冶炼,铜、锌等的精炼也都用的是电解法;②机械工业要用电镀、电抛光、电泳涂漆等来完成部件的表面精整;③环境保护可用电渗析的方法除去氰离子、铬离子等污染物;④化学电源;⑤金属的防腐蚀问题,大部分金属腐蚀是电化学腐蚀问题;⑥许多生命现象如肌肉运动、神经的信息传递都涉及到电化学机理;⑦应用电化学原理发展起来的各种电化学分析法已成为实验室和工业监控的不可缺少的手段。[1]
溶液分离
利用电化学手段分离溶液中的金属离子、有机分子的方法,共分四类:[2]
1.控制电位的电解分离法
当溶液中存在两种或两种以上的金属离子时,如果它们的还原电位相近,例如Cu(标准电极电位E0=+0.345伏)和Bi(E0=+0.2伏),则在电解时都会还原析出,达不到分离的目的。两种金属离子A和B的分解电位表示,如果控制阴极电位为b,则金属离子A可产生强度为d的电流,即可被还原;而金属离子B的电流强度极小,即几乎不能被还原,这样即可达到分离目的,并分别测定A和B。在电解过程中,阴极电位Ec是在不断变化的。至于选择什么电位要看实验条件,例如在分别测定Cu和Bi时,由于两者电位太相近,需要在溶液中加入酒石酸,调节pH=5.8~6.0,Bi与酒石酸生成的络合物比Cu的稳定得多,使两者的分解电压相差得大一些,然后再加入适量的肼,以加速Cu的还原。在这种条件下,控制阴极电位为-0.30伏,铜先电解出来,称出阴极的增重后,调节pH为4.5~5.5,控制阴极电位为-0.40伏,可将铋全部电解出来。如果溶液中还有Pb,可将电位控制在-0.50伏,进行电解。应用此法时,后被电解的离子的浓度不能超过先被电解的离子的浓度。
2.汞阴极电解分离法
H□在汞阴极上被还原时,有很大的超电压,所以在酸性溶液中可以分离掉一些容易被还原的金属离子,使一些重金属(如铜、铅、镉、锌)沉积在汞阴极上,形成汞齐,同时保留少量不容易被还原的离子,如碱金属、碱土金属、铝、铁、镍、铬、钛、钒、钨、硅等。
3.内电解分离法
在酸性溶液中,利用金属氧化-还原电位的不同,可以组成一个内电解池,即不需要外加电压就可以进行电解。例如要从大量铅中分离微量铜,在硫酸溶液中Cu比Pb先还原,因此可将铅板作为一个电极,与铂电极相连,组成一个内电解池,它产生一个自发的电动势,来源于Pb的氧化和Cu的还原。这个电动势使反应能够进行,直到电流趋近于零时,内电解池就不再作用了。内电解可以分离出微量的容易还原的金属离子,缺点是电解进行缓慢,因此应用不广。
4.电渗析法
液体中的离子或荷电质点能在电场的影响下迁移。由于离子的性质不同,迁移的速率也不同,正负电荷移动的方向也不同。当在电池的两极加上一个直流电压时,可以把一些有机物的混合物分离。如临床实验中常用此法研究蛋白质,将试样放在一个载器上,外加电场后,荷电质点沿着载器向电荷相反的电极迁移,因它们移动的速率不同而分离,一般能把血清蛋白分成五部分。改进实验技术可使浓缩斑点的宽度达到25微米左右,然后进行电渗析,可将血清蛋白分成二十个很清晰的部分。
电化学分析法

相关书籍
基于溶液电化学性质的化学分析方法。电化学分析法是由德国化学家C.温克勒尔在19世纪首先引入分析领域的,仪器分析法始于1922年捷克化学家J.海洛夫斯基建立极谱法。电化学分析法的基础是在电化学池中所发生的电化学反应。电化学池由电解质溶液和浸入其中的两个电极组成,两电极用外电路接通。在两个电极上发生氧化还原反应,电子通过连接两电极的外电路从一个电极流到另一个电极。根据溶液的电化学性质(如电极电位、电流、电导、电量等)与被测物质的化学或物理性质(如电解质溶液的化学组成、浓度、氧化态与还原态的比率等)之间的关系,将被测定物质的浓度转化为一种电学参量加以测量。
根据国际纯粹化学与应用化学联合会倡议,电化学分析法分为三大类:①既不涉及双电层,也不涉及电极反应,包括电导分析法、高频滴定法等。②涉及双电层,但不涉及电极反应,例如通过测量表面张力或非法拉第阻抗而测定浓度的分析方法。③涉及电极反应,又分为两类:一类是电解电流为0,如电位滴定;另一类是电解电流不等于0,包括计时电位法、计时电流法、阳极溶出法、交流极谱法、单扫描极谱法、方波极谱法、示波极谱法、库仑分析法等。
发展
在1663年,德国物理学家Otto von Guericke创造了第一个发电机,通过在机器中的摩擦而产生静电。这个发电机将一个巨大的硫球放入玻璃球中,并固定在一棵轴上制成的。通过摇动曲轴来转动球体,当一个衬垫与转动的球发生摩擦的时候就会产生静电火花。这个球体可以拆卸并可以用作电学试验的来源。
在17世纪中叶,法国化学家Charles François de Cisternay du Fay发现了两种不同的静电,即同种电荷相互排斥而不同种电荷相互吸引。Du Fay发布说电由两种不同液体组成:"vitreous"(拉丁语”玻璃“),或者正电;以及"resinous",或者负电。这便是电的双液体理论,这个理论被17世纪晚期Benjamin Franklin的单液体理论所否定。
1781年,查尔斯.奥古斯丁库仑(Charles-Augustin de Coulomb)在试图研究由英国科学家Joseph Priestley提出的电荷相斥法则的过程中发展了静电相吸的法则。